2. 贵州大学 贵州省材料结构与强度重点实验室,贵阳 550025
2. Key Laboratory for Material Structure and Strength of Guizhou Province, Guizhou University, Guiyang 550025
植入人体内的生物医用材料必须对人体无毒性、无致敏性、无刺激性、无遗传毒性和无致癌性,对人体组织、血液、免疫等系统不产生不良反应[1]。羟基磷灰石(HA)属于无毒的磷酸盐系无机非金属材料。HA是人体骨骼组织主要的无机成分,具有极佳的生物活性和生物相容性。但HA的力学性能较差,容易发生断裂,不能在承重部位使用,而传统的钛合金医用材料具有优良的力学性能。因此金属基体与HA的复合材料就成为研究的一个热点。20世纪80年代中期,利用等离子喷涂技术[2-5],在钛合金表面成功制备了HA涂层。之后,电化学沉积法也被用于在钛合金表面制备HA涂层[6-7]。两种方法制备的涂层均匀性良好,但都存在涂层与基体结合强度差的问题[8-9]。
激光熔覆法是在金属基体上预置一定配比的CaHPO4·2H2O,CaCO3粉末,利用激光器进行熔覆,得到含有HA的生物陶瓷涂层,这种方法制备的涂层与基体结合强度高。但是由于陶瓷粉末与金属基体的热膨胀系数差别较大,涂层与基体间不可避免的会出现大量裂纹。有研究表明稀土元素可以明显改善涂层的的组织结构,减少裂纹[10-12]。高家诚等研究发现稀土氧化物Y2O3可以细化激光熔覆涂层组织,并催化合成HA[13]。刘其斌等采用梯度激光熔覆技术成功在医用钛合金表面制备了含HA的梯度生物陶瓷涂层,解决了涂层与医用钛合金的结合强度问题[14-17]。同时发现掺杂0.6% La2O3时,涂层中HA的生成量最大,涂层的生物活性最好[18]。但是,在实际的加工过程中,涂层始终存在裂纹多,均匀性差的问题。
Si是人体新骨形成的重要元素之一,有研究表明SiO2不仅可以单独改善生物涂层的性能,同时还可以与掺杂的稀土氧化物Y2O3共同作用,优化陶瓷涂层的组织结构[19-20]。但SiO2在激光熔覆制备生物陶瓷涂层方面应用的研究较少。文中在La2O3掺杂质量分数为0.6%的生物陶瓷涂层[18]的基础上,继续掺杂质量分数为0%、5%、10%和15%SiO2,研究SiO2对掺杂La2O3涂层性能的影响。
1 试 验 1.1 材料与试剂选用医用钛合金Ti6-Al4-V作为基体,尺寸为50 mm×30 mm×5 mm,熔覆材料为分析纯的CaHPO4·2H2O,CaCO3,La2O3和SiO2粉末和粒度为45~50 μm的Ti粉。DMEM培养基(含10%的胎牛血清,1%的青霉素和链霉素),模拟体液(SBF),磷酸盐缓冲液(PBS),二甲基亚砜(DMSO),MTT溶液,24孔板,96孔板,小鼠破骨前体细胞RAW264.7。
1.2 涂层制备HA中的Ca/P为1.67,但是在激光熔覆过程中存在Ca和P的烧损,尤其是P的烧损,故采用Ca/P为1.4进行配粉,熔覆层的梯度成分设计如表1所示。表中M代表CaHPO4·2H2O,CaCO3,La2O3的混合粉末,Y代表SiO2所占混合粉末M的质量比重,4种涂层每层中加入的SiO2的质量分数分别为M质量的0%、5%、10%和15%。
| Mass of combined powders / g | M | Ti | SiO2 |
| Gradient layer 1 | 30 | 70 | 30×Y% |
| Gradient layer 2 | 70 | 30 | 70×Y% |
| Gradient layer 3 | 100 | 0 | 100×Y% |
| M: 81.12%CaHPO4·2H2O+18.88%CaCO3+0.6%La2O3 Y:0, 5, 10, 15 | |||
利用金相砂纸将基体钛合金表面打磨平整,除去氧化层。用酒精将基体清洗干净,并干燥处理。采用预置粉末的方法在基体上预置第一层粉末并用TFL-H10000型10 kW横流CO2激光器进行激光熔覆。待第一层熔覆过程结束,试样冷却后,用钢刷将涂层表面打磨平整,并涂上第二层粉末,继续熔覆加工过程直到三层粉末熔覆结束。
由于激光熔覆是快速加热,快速冷却的过程,所以稳定的激光加工参数对涂层中HA的生成至关重要。太高的加工功率和过慢的扫描速度会使熔池温度过高,生成的HA发生分解,同时基体中的Ti会稀释陶瓷涂层,所以HA的生成量减少。而加工功率过低,扫描速度过快,会使涂层粉末与基体表面熔化不充分,不能形成结合强度较高的冶金结合。所以选用较低的加工功率,和较慢的扫描速度,保证熔池中的能量密度适合,可以降低陶瓷涂层的稀释度,保证HA的生成量。
在课题组之前的工作中[18],优选固定的激光熔覆参数为,红外激光波长λ=10.6 μm,加工功率为P=1.8 kW,光斑直径D=4 mm,扫描速度V=240 mm/min。激光熔覆后的样品经过线切割,制成尺寸为10 mm×10 mm× 3 mm的试样。将样品分别用石油醚,丙酮,无水乙醇,超净水(UP水, Ultrpure water)超声波清洗10 min,除去试样表面的油渍,接着放入干燥箱,烘干。
使用OLYMPUS GX51型金相显微镜对试样截面进行形貌分析。使用采用D/Max-2200型X衍射测试仪分析涂层物相。
1.3 模拟体液(SBF)浸泡实验将试样分别放置于4组离心管中,加入等量的SBF溶液。每隔一天换液一次,连续浸泡两周。两周后,将试样从SBF溶液中取出,用UP水轻轻冲洗后放入干燥箱。试样完全干燥后,采用SUPRA-40型扫描电镜对浸泡14 d后的涂层进行组织形貌观察;采用D/Max-2200型X衍射测试仪分析涂层物相。
1.4 MTT细胞活性测试将试样从干燥箱中取出,经过高温灭菌后使用。将不同SiO2添加量的试样和未添加SiO2的试样分为4组,每组3个平行样。将试样放入24孔板里,每孔加入1 mL含有小鼠破骨前体细胞RAW264.7的培养基,细胞密度为1×105个/mL。
细胞与试样放于温度为37 ℃,含有5%CO2的孵育箱中共同培养2,4和6 d,每隔1 d换培养基。在以上3个时间点,于 24孔板中,每孔加入200 μL MTT溶液,放入37 ℃的恒温箱中避光保温4 h,4 h后将液体移出24孔板,每孔加入1 mL DMSO,避光振荡15 min后,每孔取200 μL溶液转移到96孔板中,使用酶联免疫检测仪(THERMO Varioskan flash)分别各组的光密度(OD, optical density)值。
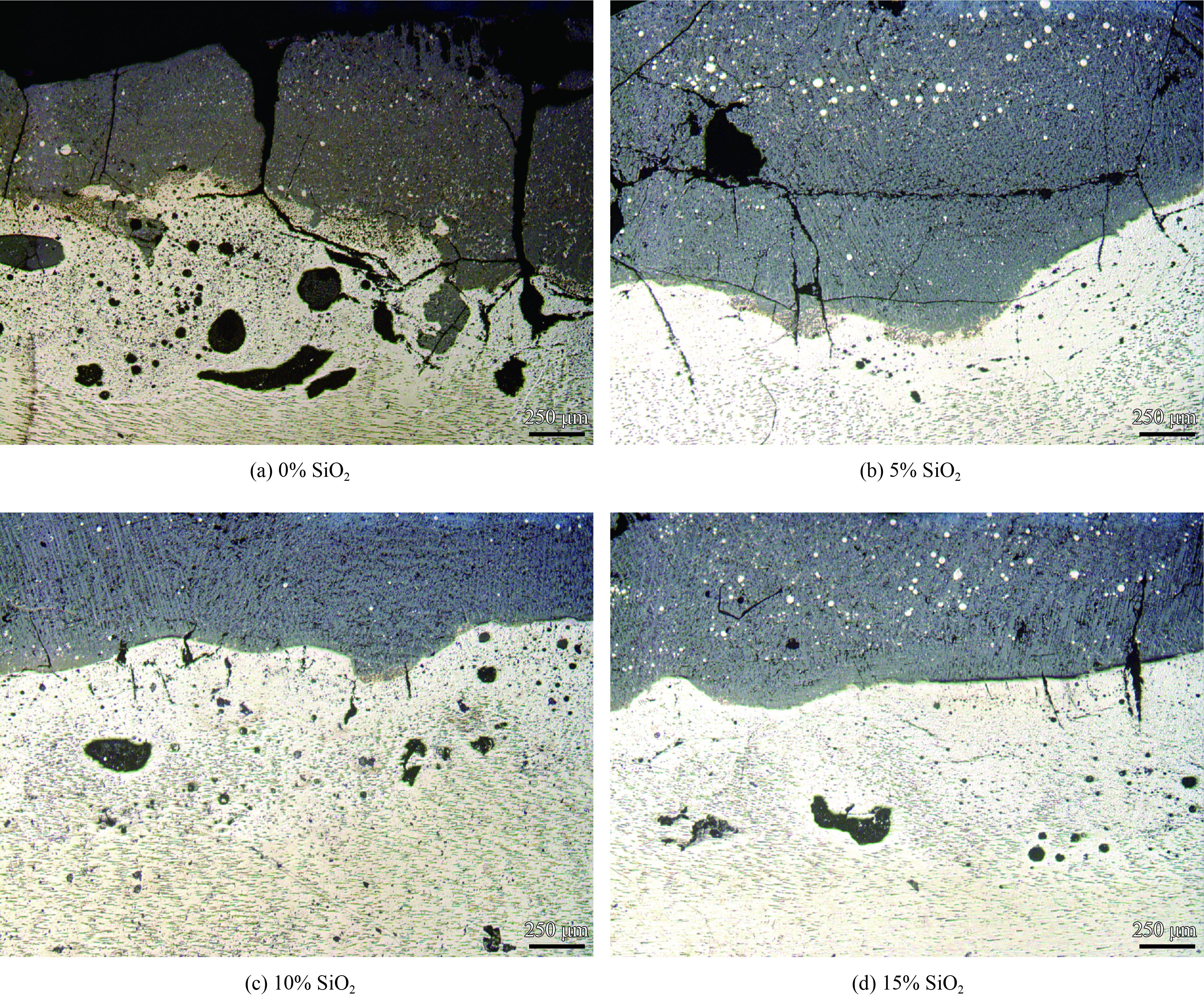
2 结果与讨论 2.1 涂层横截面分析图1为未掺杂SiO2的涂层横截面(图1(a))与掺杂5% SiO2的涂层横截面(图1(b)),10% SiO2的涂层横截面(图1(c)),15% SiO2(图1(d))的对比。从图中可以看出,随着SiO2掺杂量的增加,涂层中纵贯的宽长裂纹明显减少,涂层烧结的质量提高。当SiO2掺杂量为10%~15%时,熔覆涂层的质量最好。纵贯裂纹的减少和致密的合金化层,使基体中的重金属离子游离到人体中的几率大大降低,保证了涂层对人体健康的安全性。同时,涂层中一些微小的裂纹和孔洞依然存在。这种多孔的结构为新骨在涂层表面的生长提供了有利条件,新骨在长满较小空隙的时间要少于长满较大孔的时间,所以微孔结构的涂层在植入人体后完成骨修复的效果更好[21]。纵贯裂纹减少的原因可能是:加入SiO2后,在熔覆的过程中,SiO2可以推动熔池流动,改善了熔池的流动性,使涂层更加的致密均匀。
|
| 图 1 不同SiO2含量陶瓷涂层的横截面形貌 Figure 1 Cross section morphologies of ceramic coatings with different content of SiO2 |
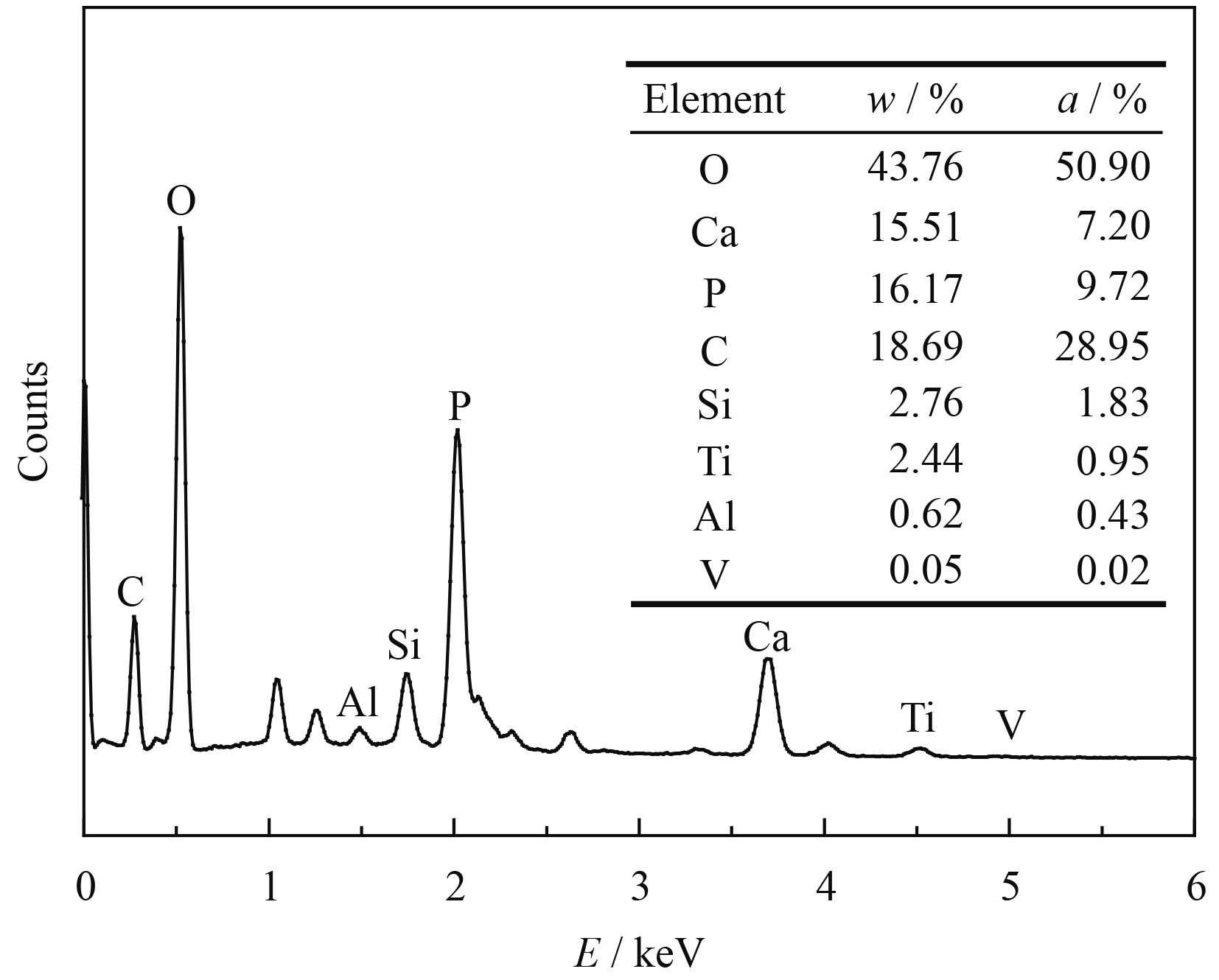
图2为掺杂10% SiO2涂层的横截面OM图,从图中可以看出,涂层明显的可以分为3部分,自上而下分别为陶瓷层,合金化层和基体。基体与合金化层之间过渡均匀,并没有出现明显的结合界面,说明两者之间发生了大量的相互扩散,这使得基体与合金化层之间具有较高的结合强度。合金化层与陶瓷涂层之间没有明显的纵贯裂纹,在保证陶瓷涂层与合金化层之间结合强度的同时,减小了重金属离子游离到涂层表面的几率。
如图2中,沿该涂层表面到基体方向,分别在陶瓷层(区域A),陶瓷层与合金化层结合部(区域A、B间),合金化层(区域B),合金化层与基体结合部(区域B、C间)做线性EDS分析,其不同层的EDS结果如表2所示。从表2中可以看出,Ti元素的含量沿涂层表面到基体方向呈现一个递增趋势,这与表1中各熔覆层的成分恰好相对应。而Ca元素在合金化层中的含量也较高,原因可能是在激光熔覆的过程中,强烈的熔池对流将Ca元素带到了熔池下部。在合金化层与基体结合部,Al和V元素的质量分数增加。

|
| 图 2 掺杂10% SiO2陶瓷涂层的横截面OM图 Figure 2 Cross section OM image of ceramic coating with 10% SiO2 |
| Area | O | Ca | P | C | Si | Ti | V | Al |
| A | 42.22 | 9.90 | 6.45 | 33.36 | 1.58 | 5.61 | 0.17 | 0.71 |
| A→B | 36.52 | 17.39 | 0.63 | 19.42 | 1.83 | 22.41 | 0.25 | 1.54 |
| B | 33.28 | 22.00 | 0.58 | 8.85 | 1.78 | 31.42 | 0.22 | 1.86 |
| B→C | 5.99 | 0.07 | 0.11 | 7.02 | 0.25 | 78.17 | 3.79 | 4.60 |
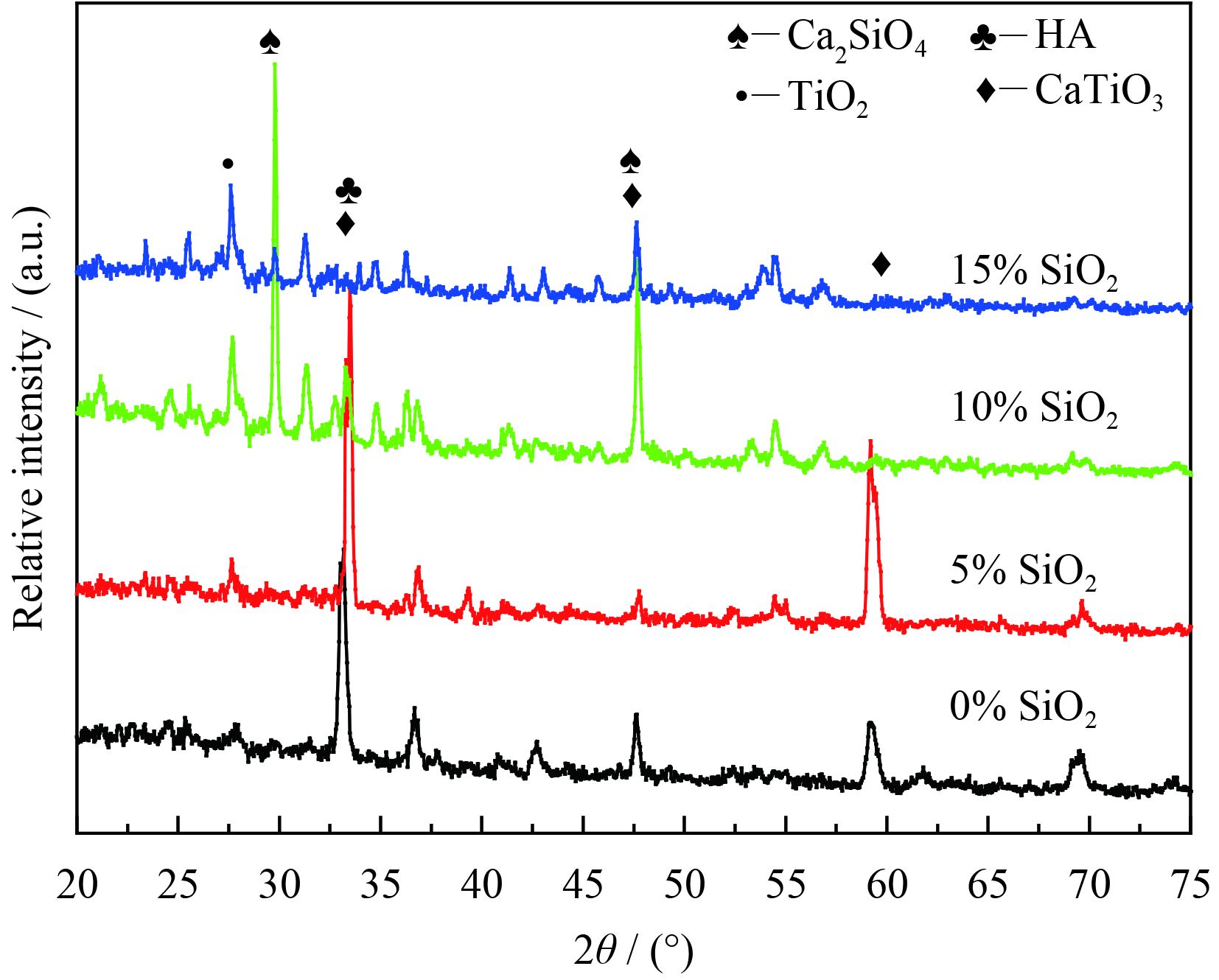
图3为涂层X射线衍射图谱。从图中可以看出掺杂5% SiO2后,与未掺杂SiO2的涂层相比,CaTi和生物活性相HA的衍射峰会会有一定程度的增强。这是可能因为少量SiO2的加入增强了熔池的流动性,增加了冷却形核的质点,促进了CaTiO3和生物活性相HA的形核。当加入10% SiO2时,出现了较强的Ca2SiO4衍射峰,这是因为一部分复合陶瓷粉末(CaHPO4·2H2O,CaCO3)不可避免的会与掺杂的SiO2反应,生成CaSiO4,这就使利用CaCO3与CaHPO4·2H2O反应生成HA的过程受到影响,导致HA生成量减少。熔覆过程中,基体和混合粉末中的Ti会在涂层表面与O2反应生成TiO2,TiO2会进一步与CaCO3分解产物CaO反应生成CaTiO3。掺杂10% SiO2后,由于SiO2的尺寸较大,阻碍了Ti移动到涂层表面与O2反应生成TiO2,所以CaTiO3的生成量与会相应下降。当SiO2掺杂量达到15%时,SiO2过量,涂层中Ca(TiO)(SiO4)生成,使得Ca2SiO4,CaTiO3,HA的生成量都会有所降低。
|
| 图 3 不同SiO2含量陶瓷涂层的XRD图谱 Figure 3 XRD patterns of ceramic coatings with different content of SiO2 |
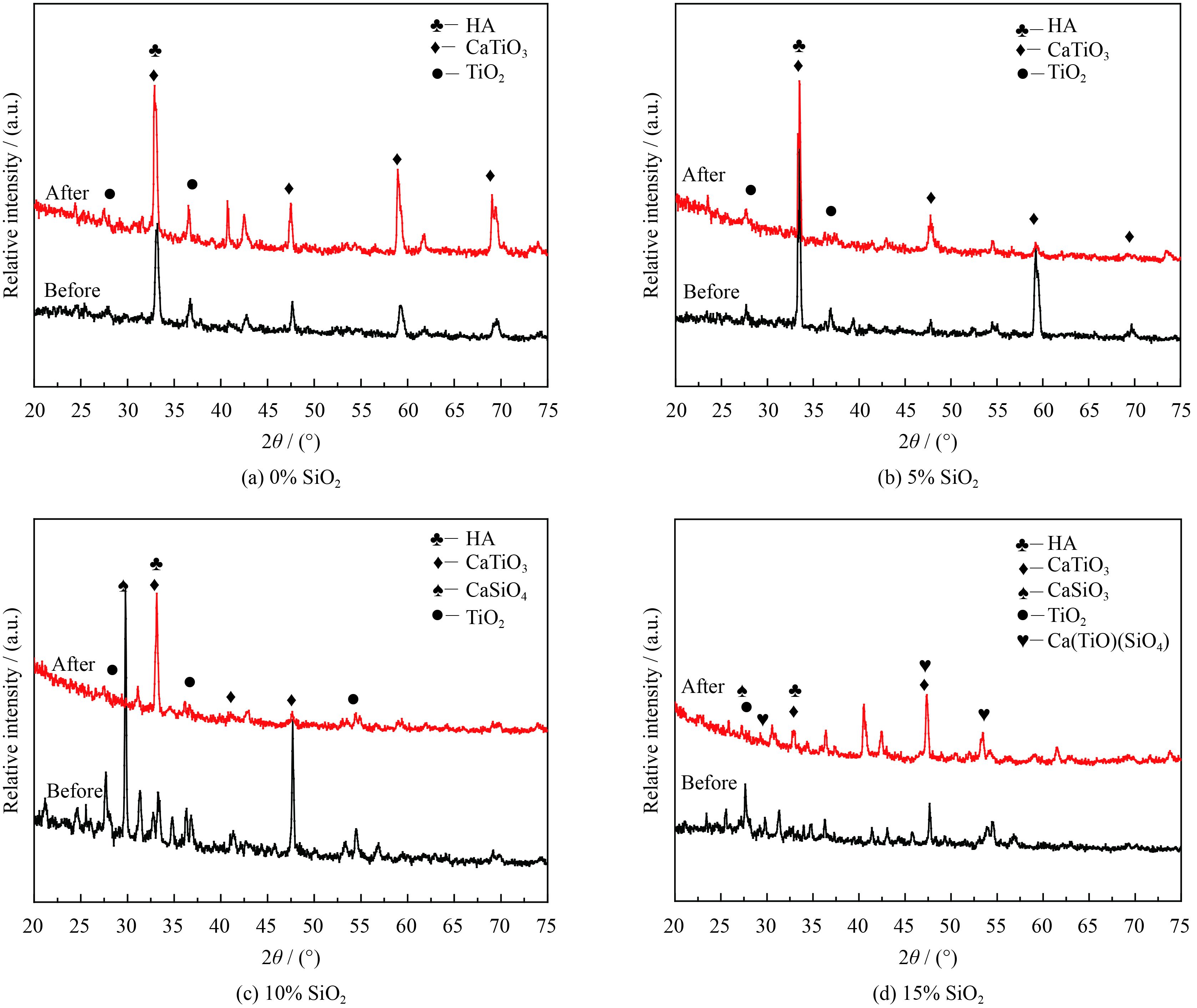
图4为未掺杂SiO2涂层(图4(a))与SiO2分别掺杂5%(图4(b)),10%(图4(c)),15%(图4(d))的涂层在SBF中浸泡前与浸泡2周前后的X射线衍射图谱。从图中可以看出,在SBF中浸泡两周后,所有涂层表面生物活性HA的衍射峰均有提高,这表明所有涂层在SBF中均具良好的沉积HA的功能,表现出优良的生物活性。
进一步比较4种涂层浸泡前后的XRD图谱,可以看出掺杂10% SiO2后,涂层在浸泡两周后HA的衍射峰增强最明显,这表明涂层在SBF中沉积HA的量要多于其它3组涂层表面沉积的量。此外,从图4(c)中可以看出,涂层浸泡两周后,TiO2,CaTiO3和CaSiO4的衍射峰的强度明显下降。这些现象的原因可能是:掺杂SiO2的涂层中析出Ca2+的速度要大于Si4+析出的速度,使SBF的PH值增加迅速,这加速了Ca2+,PO43-和OH-的消耗和HA的形成[22]。同时,涂层表面会形成带负电Si−O官能团,更多带正电的Ca2+会被吸收到涂层表面参与HA生成反应[19],而掺杂10% SiO2的涂层中含有较多的Ca2SiO4,涂层表面可以形成更多的Si−O官能团,这使得掺杂10% SiO2的涂层在SBF中获得了更加优异的沉积HA的能力。类骨磷灰石层在涂层表面的沉积,使TiO2,CaTiO3和CaSiO4的信号减弱,表现在XRD图谱中就是三者的衍射峰强度降低。
|
| 图 4 不同SiO2含量陶瓷涂层在模拟体液中浸泡14天后的XRD图谱 Figure 4 XRD patterns of ceramic coatings with different content of SiO2 immersed in SBF for 14 days |
图5为4种涂层在SBF中浸泡2周后,涂层表面的SEM显微形貌图。从图中可以看到4种涂层表面都有大量白色类骨磷灰石的生成,这表明掺杂SiO2的涂层也具有优良的生物活性,且掺杂10% SiO2后,涂层表面沉积的白色类骨磷灰石相最多,且涂层表面仍然存在尺寸较小的孔洞,有利于新骨的生长。
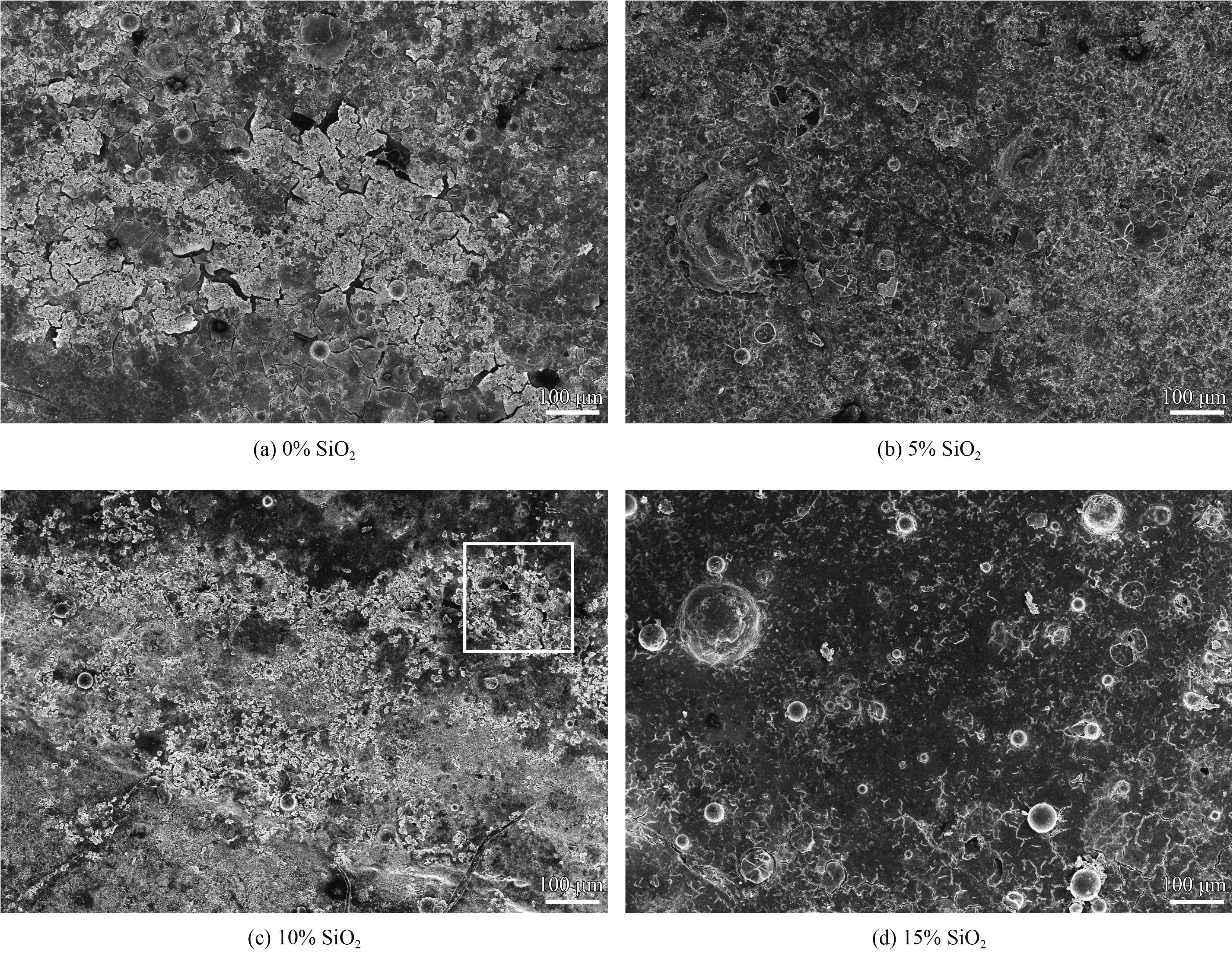
|
| 图 5 不同SiO2含量陶瓷涂层在模拟体液中浸泡14天后的形貌 Figure 5 Morphologies of ceramic coatings with different concent of SiO2 immersed in SBF for 14 days |
对SiO2掺杂量为10%的涂层浸泡后表面进行能谱(EDS)分析。图6为涂层表面白框区域内的EDS分析结果。从图中可以看出,涂层的表面成分主要含有Ca、P、O、C、Si等元素,而这些元素几乎全部来自原料中的混合陶瓷粉末(CaHPO4·2H2O,CaCO3)和SiO2。而基体与合金化层中的占绝大多数的Ti元素和其中的一些金属元素,在涂层表面的含量却非常少,这表明陶瓷涂层与合金化层之间紧密的结合与较少裂纹的存在,有效的阻碍了基体与合金化层中的金属离子游离到涂层表面,避免了涂覆有该涂层的人工假体在植入人体后金属离子析出对人体的损伤。
2.4 MTT分析MTT法是检测细胞活性常用的方法,光密度值(OD值)大小反映了细胞活性的强弱。图7为小鼠破骨前体细胞RAW264.7在上述4种涂层表面培养2、4和6 d这3个时间点后,采用MTT法测定的3个时间点OD值。从图中可以看出,随着培养时间的延长,4种涂层表面种植的RAW264.7细胞的活性呈下降趋势,且随着掺杂SiO2掺杂量的增加,陶瓷涂层对RAW264.7细胞的活性具有更加明显的抑制作用。原因可能是:涂层中一定浓度的La3+会抑制小鼠破骨前体细胞RAW264.7某些基因的表达[23],从而抑制其的活性,而涂层继续掺杂SiO2后,涂层中的Si可以直接抑制破骨前体细胞的活性[24],这就使得含SiO2涂层对破骨前体细胞活性有更加明显的抑制作用。
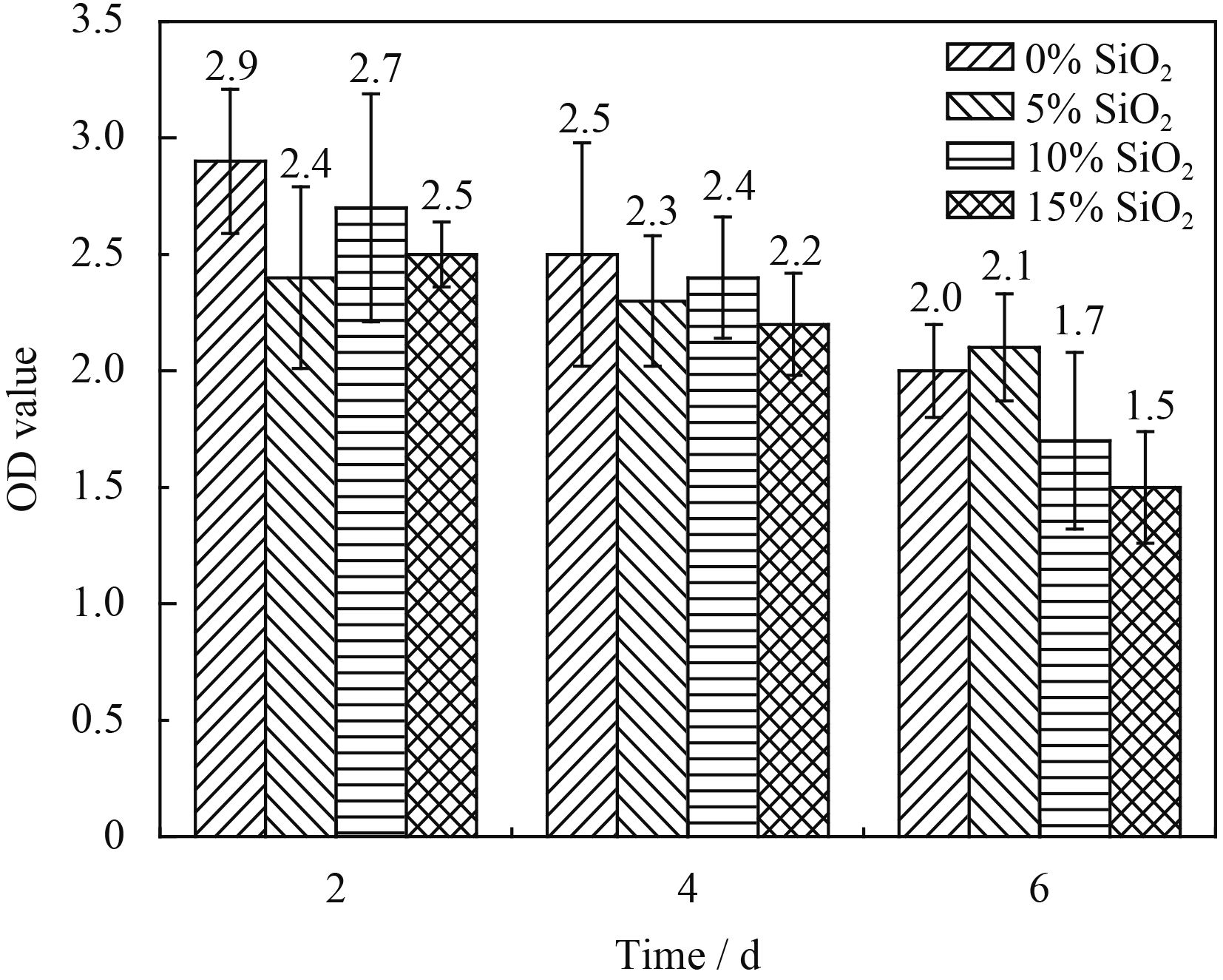
|
| 图 7 RAW264.7细胞在不同SiO2含量陶瓷涂层表面的增殖结果 Figure 7 Proliferation of RAW 264.7 on the surface of ceramic coatings with different content of SiO2 |
上述抑制作用的意义在于:为防治人工关节磨屑病提供思路。在运动中,人工关节不可免的会产生一些磨屑,磨屑会刺激破骨细胞的骨吸收功能的表达,造成人工关节的松动而失效,这就是所谓的磨屑病[25]。表面涂覆有含SiO2涂层的人工关节会抑制破骨前体细胞的活性,进而由破骨前体细胞分化成熟的破骨细胞的数目会相应的减少,骨收功能减弱,人工关节使用寿命增加。
3 结 论(1)掺杂SiO2后,含La2O3生物陶瓷涂层的烧结质量提高,当SiO2掺杂量为10%~15%时,纵贯涂层与基体的裂纹明显减少,涂层与基体间的结合更加紧密。
(2) 5% SiO2的掺杂会促进含La2O3涂层中HA的生成,掺杂10% SiO2后,含La2O3涂层中CaTiO3的生成量明显减少,HA相生成量也相应减少,生成了大量Ca2SiO4。
(3) 在模拟体液(SBF)中,掺杂10% SiO2的含La2O3涂层具有更加优异的沉积羟基磷灰石(HA)的能力,生物活性更加优异,同时涂层表面检测到的重金属元素含量稀少,表明涂层有效阻止了基体中重金属离子的释放。
(4) 随着SiO2掺杂量增加,含La2O3涂层对小鼠破骨前体细胞RAW264.7活性的抑制作用更加明显,涂覆掺杂SiO2的含La2O3涂层的人工关节对防治磨屑病的效果更好。
| [1] |
俞耀庭. 生物医用材料[M]. 天津: 天津大学出版社, 2000: 116-142.
YU Y T. Biomedical materials[M]. Tianjin: Tianjin University Press, 2000: 116-142 (in Chinese). |
| [2] | GROOT K D, GEESINK R, KLEIN C P A T, et al. Plasma sprayed coatings of hydroxyapatite[J]. Journal of Biomedical Materials Research, 1987, 21(12): 1375-1381. |
| 点击浏览原文 | |
| [3] | THOMAS K A, KAY J F, COOK S D, et al. The effect of surface macrotexture and hydroxylapatite coating on the mechanical strengths and histologic profiles of titanium implant materials[J]. Journal of Biomedical Materials Research, 1987, 21(12): 1395-1414. |
| 点击浏览原文 | |
| [4] | CHEANG P, KHOR K A, TEOH L L, et al. Pulsed laser treatment of plasma-sprayed hydroxyapatite coatings[J]. Biomaterials, 1996, 17(19): 1901-1904. |
| 点击浏览原文 | |
| [5] | GROSS K A, BERNDT C C. In vitro, testing of plasma-sprayed hydroxyapatite coatings[J]. Journal of Materials Science Materials in Medicine, 1994, 5(4): 219-224. |
| 点击浏览原文 | |
| [6] | KRAUSE D, THOMAS B, LEINENBAEH C, et al. The electrophoretic deposition of bioglass®; particles on stainless steel and Nitinol substrates[J]. Surface & Coatings Technology, 2006, 200(16-17): 4835-4845. |
| [7] |
胡皓冰, 林昌健, 陈菲, 等. 电化学沉积制备羟基磷灰石涂层及机理研究[J]. 电化学, 2002, 8(3): 288-294.0
HU H B, LIN C J, CHEN F, et al. Pure HAP film prepared by direct electrodepositing on metallic surface and its mechanism[J]. Journal of Electrochemistry, 2002, 8(3): 288-294(in Chinese). |
| 点击浏览原文 | |
| [8] |
任强, 武秀兰. 钛基羟基磷灰石涂层制备技术的研究进展[J]. 中国陶瓷, 2004, 40(1): 35-37.0
REN Q, WU X L. Progress in manufacture technology for titanium-based hydroxyapatite coatings[J]. China Ceramic, 2004, 40(1): 35-37(in Chinese). |
| 点击浏览原文 | |
| [9] | JI H, PONTON C B, MARQUIS P M. Microstructural characterization of hydroxyapatite coating on titanium[J]. Journal of Materials Science: Materials in Medicine, 1992, 3(4): 283-287. |
| 点击浏览原文 | |
| [10] |
马运哲, 董世运, 徐滨士, 等. CeO2对激光熔覆Ni基合金涂层组织与性能的影响[J]. 中国表面工程, 2006, 19(1): 7-11.0
MA Y Z, DONG S Y, XU B S, et al. Effect of CeO2 on microstructure and properties of laser cladding Ni based alloy coatings[J]. China Surface Engineering, 2006, 19(1): 7-11(in Chinese). |
| 点击浏览原文 | |
| [11] | WANG D, CHEN C, MA J, et al. Microstructure of yttric calcium phosphate bioceramic coatings synthesized by laser cladding[J]. Applied Surface Science, 2007, 253(8): 4016-4020. |
| 点击浏览原文 | |
| [12] | GUO D G, WANG A H, HAN Y, et al. Characterization, physicochemical properties and biocompatibility of La-incorporated apatites.[J]. Acta Biomaterialia, 2009, 5(9): 3512-3523. |
| 点击浏览原文 | |
| [13] |
高家诚, 张亚平, 文静. 稀土对激光涂覆生物陶瓷涂层组织的影响[J]. 稀有金属材料与工程, 1997, 26(3): 30-34.0
GAO J C, ZHANG Y P, WEN J.Effect of Y2O3 on the microstructure of laser clad bioceramiccoatings[J]. Rare Metal Materials and Engineering, 1997, 26(3): 30-34(in Chinese). |
| 点击浏览原文 | |
| [14] | LIU Q B, ZOU L J, ZHENG M, et al. Effect of Y2O3 content on microstructure of gradient bioceramic composite coating produced by wide-band laser cladding[J]. Journal of Rare Earths, 2005, 288-289(4): 446-450. |
| [15] | LIU Q B, LI W F, YANG B C. Microstructure and biocompatibility of gradient bioceramic composite coating fabricated by wide-band laser cladding[J]. Key Engineering Materials, 2007, 342-343: 685-688. |
| 点击浏览原文 | |
| [16] | LIU Q B, LING W U, YANG B. Gradient rare-earths bioceramic composite coating fabricated by wide-band laser cladding and its bioactivity[J]. Materials Science Forum, 2009, 610-613: 1224-1226. |
| 点击浏览原文 | |
| [17] |
蒋海兵, 刘其斌, 张玲琰. Y2O3-CeO2稀土氧化物对激光熔覆生物陶瓷涂层中HA的影响[J]. 中国表面工程, 2014, 27(3): 38-42.0
JIANG H B, LIU Q B, ZHANG L Y. Effect of rare earth oxides Y2O3-CeO2 on HA of bioceramic coating fabricated by laser cladding[J]. China Surface Engineering, 2014, 27(3): 38-42(in Chinese). |
| 点击浏览原文 | |
| [18] |
白杨, 刘其斌, 徐鹏, 等. 稀土含量对Ca-P陶瓷涂层组织及细胞相容性的影响[J]. 中国表面工程, 2016, 29(5): 66-71.0
BAI Y, LIU Q B, XU P, et al. Effect of rare earth content on microstructure and cell compatibility of Ca-P ceramic coating fabricatedby laser cladding[J]. China Surface Engineering, 2016, 29(5): 66-71(in Chinese). |
| 点击浏览原文 | |
| [19] | MUMJITHA M, RAJ V. Fabrication of TiO2-SiO2 bioceramic coatings on Ti alloy and its synergetic effect on biocompatibility and corrosion resistance[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2015, 46: 205-221. |
| 点击浏览原文 | |
| [20] | LI H C, WANG D G, CHEN C Z, et al. Effect of CeO2 and Y2O3 on microstructure, bioactivity and degradability of laser cladding CaO-SiO2 coating on titanium alloy[J]. Colloids and Surfaces B: Biointerfaces, 2015, 127: 15. |
| 点击浏览原文 | |
| [21] |
张聪, 郑长福, 李颖明, 等. 多孔HA/β-TCP生物活性复合陶瓷诱导成骨的实验研究[J]. 中华外科杂志, 1993, 31(12): 722-725.0
ZHANG C, ZHENG C F, LI Y M, et al. Research on osteogenic induction of porous HA/β-TCP bioactive composite ceramic[J]. Journal of Chinese Surgery, 1993, 31(12): 722-725(in Chinese). |
| 点击浏览原文 | |
| [22] | SIRIPHANNON P, KAMESHIMA Y, YASUMORIA, et al. Formation of hydroxyapatite on CaSiO3, powders in simulated body fluid[J]. Journal of the European Ceramic Society, 2002, 22(4): 511-520. |
| 点击浏览原文 | |
| [23] |
邹飏, 江川, 刘翔, 等. 氯化镧对RAW264.7细胞分化为破骨细胞作用的实验研究[J]. 重庆医学, 2014, 43(26): 3480-3482.0
ZOU Y, JIANG C, LIU X, et al. Study on the effect of lanthanum chloride on the differentiation of RAW264.7 cells into osteoclasts[J]. Chongqing Medicine, 2014, 43(26): 3480-3482(in Chinese). |
| 点击浏览原文 | |
| [24] | MLADENOVIĆ Ž, JOHANSSON A, WILLMAN B, et al. Soluble silica inhibits osteoclast formation and bone resorption in vitro[J]. Acta Biomaterialia, 2013, 10(1): 406-18. |
| [25] | MINODA Y, KOBAYASHI A, SAKAWA A, et al. Wear particle analysis of highly crosslinked polyethylene isolated from a failed total hip arthroplasty[J]. Journal of Biomedical Materials Research Part B Applied Biomaterials, 2008, 86(2): 501-505. |