2. 西安交通大学 金属材料强度国家重点实验室,西安 710049;
3. 湖北省肿瘤医院 胃肠外科,武汉 430060;
4. 安徽理工大学 医学检验中心,安徽 淮南 232001
2. State Key Laboratory for Mechanical Behavior of Materials, Xi’an Jiaotong University, Xi’an 710049;
3. Department of Gastrointestinal Surgery, Hubei Cancer Hospital, Wuhan 430060;
4. Medical Inspection Center, Anhui University of Science and Technology, Huainan 232001, Anhui
在生物医用金属材料中,钛具有较小的密度,良好的生物相容性,化学稳定性及力学性能,成为硬组织替换或修复的首选材料[1]。然而,钛基金属属于生物惰性材料,植入体内后与周围组织不能形成良好的化学键合,常被纤维组织包裹而与宿主组织隔离开来,易引起血栓从而导致植入失败[2]。因此,在临床上,对钛基金属表面进行生物活化改性提高其骨整合能力具有重要的意义。
由于植入体与体液或血液接触的是材料表面,近些年来在钛基金属表面制备一层纳米结晶层对植入体表面进行生物活化改性的方法引起了生物材料研究者们的注意。宿主组织细胞对植入体表面的响应效应与其表面结构形态以及微纳尺度有着密切的关系,而骨基质主要由纳米级胶原纤维和镶嵌于其周围的纳米HA颗粒构成,呈纳米形态,从仿生角度来看,在钛基金属表面制备一层纳米结晶层将会有效改善其上成骨细胞的响应[3-4]。目前大量的研究结果证实了这一点,Zhao等人采用表面机械研磨(SMAT)的方法在纯钛[5]及Ti6Al4V[6]表面制备出一层晶粒尺度为20~40 nm的纳米晶,体内及体外试验结果证实,所制备的纳米表层更能促进成骨细胞的黏附、增殖、分化及矿化。Lai等人采用SMAT的方法在纯钛表面制备出了一层晶粒尺度为60~80 nm的纳米晶,发现获得的纳米表面不仅能改善间充质干细胞的黏附与增殖,而且对干细胞的骨向分化也具有促进作用[7]。Deng等人采用喷丸的方法在纯钛表面制备出一层晶粒尺度约为60 nm的纳米结晶表层,结果显示该纳米表面对其上培养的MG63细胞黏附、铺展及分化情况均具有促进作用[8]。Guo等人采用高能喷丸的方法在纯钛表面制备出晶粒尺度为57~88 nm的纳米层,结果证实该纳米表层不仅能促进MG63细胞的黏附、增殖、分化及矿化,并且在体内植入时对兔子骨组织的生长亦具有促进作用[9]。然而值得注意的是,SMAT及喷丸处理制备出的钛基金属样品表面坑凹不平、粗糙度大,多表现为峰峦起伏的拓扑结构,和处理前光滑平整的样品对比,上述研究工作在表面纳米化的同时亦改变了材料表面的粗糙度及拓扑结构,揭示的是表层综合性质对细胞的作用,而晶粒细化至纳米级时,晶界单因素对细胞行为具有怎样的影响目前尚鲜有报道。
文中采用SMAT的方法对Ti-25Nb-3Mo-3Zr-2Sn(简称TLM),一种新型β-Ti钛合金[10]表面进行预处理,在SMAT过程中表面光滑的钢球(或者其他材料如玻璃球或陶瓷球)将以不同方向频繁作用于材料表面通过强烈塑性变形实现表面纳米化,材料应变量和应变速率均随着深度的增加而减小,因而在材料的内部会形成表面为纳米晶、晶粒尺寸沿厚度方向逐渐增大的梯度结构[11]。而后,对纳米化前后的两组样品表面进行机械抛光,去掉表层的弹坑,同时留下最厚的处理层[12],使得样品表面具有相近的微观粗糙度及拓扑结构,考察TLM钛合金表面晶粒细化单因素对成骨细胞生物学行为的影响。
1 试 验 1.1 样品制备基材采用西北有色金属研究院研制生产的Ti-25Nb-3Mo-3Zr-2Sn钛合金,简称TLM,采用中国科学院金属研究所和成都新晶格科技有限公司联合制造的SNC-I型金属材料表面纳米试验机对TLM钛合金进行SMAT处理,撞击小球采用直径为5 mm的ZrO2陶瓷球,工作频率为50 Hz,处理时间为30 min。处理完成后将SMAT前后的TLM钛合金线切割为10 mm×10 mm×5 mm的小方块作为样品,小心打磨后抛光成镜面,依次在丙酮、酒精、去离子水中分别超声清洗15 min后进行紫外光照射,高压蒸汽消毒备用。上述制备出的两组样品,后文分别用unSMATed和SMATed来命名。
1.2 样品的表面结构及性能表征UnSMATed和SMATed两组样品的相组成采用荷兰Panalytial公司的X’Pert PRO型多功能X射线衍射仪(X-ray Diffraction,XRD)进行分析,测试时采用Cu Kα X射线源,石墨单色管,管压为40 kV,管流为40 mA,连续扫描模式,步长0.02°,每步0.5 s,掠射角3°,衍射角2θ的扫描范围为30°~80°;采用德国Reichert公司的MeF3型金相显微镜(Optical microscope,OM)对unSMATed样品表面的晶粒尺寸进行观察,金相试样制备过程如下,将unSMATed样品切割后镶样,以丝绸为抛光布,氧化铬悬浊液配合铬酸为抛光剂抛光,然后在Kroll’s溶液中(5%HF+10%HNO3+85%H2O)浸蚀5 s,迅速用清水冲洗,最后用无水乙醇擦洗净吹干。采用日本JEOL公司生产的JEM-2100F型透射电子显微镜(Transmission electron microscope, TEM)分析SMATed样品表面的晶粒结构,电镜的工作电压为200 kV。
TEM薄片的制备方式如下:将SMATed样品,沿着未处理面单面磨至20~30 μm后,用冲样器制成Ф 3 mm的试样,使用美国Gatan公司的Model 691PIPS型离子减薄仪对薄片的未处理面进行减薄,减至试样穿透,于TEM下获取试样的最表面信息。采用日本岛津公司生产的SPM-9500J3型原子力显微镜(Atomic force microscope, AFM)观察两组样品表面的拓扑形貌,并测试样品表面的粗糙度,原子力显微镜使用Si3N4探针,悬臂弹性常数为60 mN/m,其成像采用非接触模式,测试结果以三维形貌显示在计算机上,再摄制成照片。选取3种具有代表性的指标Ra,Rq和Rz来评价样品表面的粗糙度,每组样品设平行样品3个,每个试样表面取不同区域测试3次,取平均值作为相应指标测试值。
采用德国Kruss公司生产的DSA30型接触角测量仪测试两组样品表面的亲水性能。测试液体采用去离子水,当水滴完全接触到样品表面时,用设备自带的相机拍照并使用DSA1分析软件对接触角进行计算。每组样品设平行样品3个,每个样品上重复测试3次,以确保试验结果的可靠性。采用非接触模式,测试结果以三维形貌显示在计算机上,再摄制成照片。选取3种具有代表性的指标Ra,Rq和Rz来评价样品表面的粗糙度,每组样品设平行样品3个,每个试样表面取不同区域测试3次,取平均值作为相应指标测试值。采用德国Kruss公司的DSA30型接触角测量仪测试两组样品表面的亲水性能。测试液体采用去离子水,当水滴完全接触到样品表面时,用设备自带的相机拍照并使用DSA1分析软件对接触角进行计算。每组样品设平行样品3个,每个样品上重复测试3次,以确保试验结果的可靠性。
1.3 蛋白吸附将制备出的unSMATed和SMATed两组样品分别置于24孔细胞培养板(美国,Corning公司)中(处理面向上放置),每组设平行试样5个,每孔中加入500 μL含10%胎牛血清的细胞培养基(美国,Hyclone公司)。于37 ℃孵育1、5、24 h后,转入新的24孔板并用1 mL的磷酸盐(PBS)缓冲液轻轻漂洗3次。然后每孔加入500 μL的1%十二烷基硫酸钠(SDS,美国Biomol公司),在摇床上振动30 min将试样表面吸附的蛋白洗脱下来。收集到SDS溶液中的蛋白浓度用Nano Drop 2000C蛋白检测仪(美国,Thermo公司)在波长为280 nm处测量。
1.4 体外细胞试验 1.4.1 细胞培养人成骨细胞系hFOBl.19购于中国科学院细胞库,用含10%胎牛血清、0.5 mmol/L丙酮酸和0.3 mg/mL G418 的DMEM/F12 1:l混合培养基,置于37 ℃、5% CO2饱和湿度细胞培养箱培养,3 d换液1次。待细胞达到80%融合时,弃去培养液,用磷酸盐缓冲液(PBS)轻柔漂洗,然后用含0.02%乙二胺四乙酸的0.25%胰酶消化,按1∶4比例传代。
1.4.2 细胞黏附按密度8×104个/mL将成骨细胞接种于24孔板中的unSMATed和SMATed样品上(处理面向上放置),每组平行样品5个,置于细胞培养箱中;培养3 h后,用300 μL的3%戊二醛,4 ℃固定1 h;吸弃戊二醛后,用30%、50%、70%、90%、95%和100%梯度酒精室温分别脱水10 min;放入真空干燥箱中干燥后,通过JEOL公司生产的JSM-6700F型扫描电镜(Scanning electron microscope, SEM)观测细胞形态。
1.4.3 细胞活性将unSMATed和SMATed两组样品放入24孔板中(处理面向上放置),每组平行样品5个,随后将成骨细胞按密度8×104个/mL种植在样品上,放入培养箱中培养至1、6、24、72及120 h时取出,吸弃培养液,用PBS缓冲液清洗3遍后将样品转移至新的空孔中。加入5 mg/mL MTT试剂50 μL及培养液450 μL放入孵化箱中继续培养4 h,小心吸弃原培养液,在每孔中加入二甲亚砜(DMSO)500 μL,室温下放置并振荡15 min,取200 μL溶解液在酶联免疫检测仪下于490 nm波长下测定其光密度(Optical density, OD)。
1.4.4 碱式磷酸酶(ALP)活性成骨细胞在unSMATed和SMATed两组样品表面培养后,其胞内ALP活性采用酶联免疫分析法评价。将总体积500 μL、含8×104个成骨细胞的细胞培养基,注入到分别放置两组样品的24孔板中,每组平行样品5个,放入培养箱中培养1、3及5 d后取出,吸弃培养液,用PBS缓冲液轻柔漂洗3次将样品转移至新的空孔中。每孔用200 μL 0.1%Triton X-100处理试样,并反复冻融5个循环裂解细胞,震荡5 min后,于4 ℃、1 000 r/min离心10 min,提取上层清液,依照ALP Elisa Kit(美国,R&D公司)操作方式,将上清液加入到已包被ALP抗体的孔板中。于酶联免疫检测仪下,在450 nm波长下检测反应液的OD值。
1.5 统计分析试验数据来自5次独立的试验,数据表示形式为均值±标准偏差形式(Mean±SD(Standard deviation)),采用SPSS14.0软件进行统计分析数据,双因素方差分析和SNK检验比较组间差别,P<0.05被认为有显著性的统计学差异。
2 结果与分析图1为unSMATed及SMATed两组钛合金样品的XRD衍射图。可以看出,SMAT处理前后的TLM钛合金样品抛光后,表层均由单一的纯β-Ti相组成,相对UnSMATed样品而言,SMATed样品对应的3个特征衍射峰β(110)、β(200)及β(211)峰强更低,且发生了明显的宽化,这是由晶粒细化和微观应变增加所致,由Scherrer和Wilsoh公式可计算得到,样品表面层约10 μm范围内的平均晶粒尺寸为46.2 nm[13]。上述结果表明经过SMAT处理,TLM钛合金表层的物相没有发生改变,但晶粒发生了明显的细化。
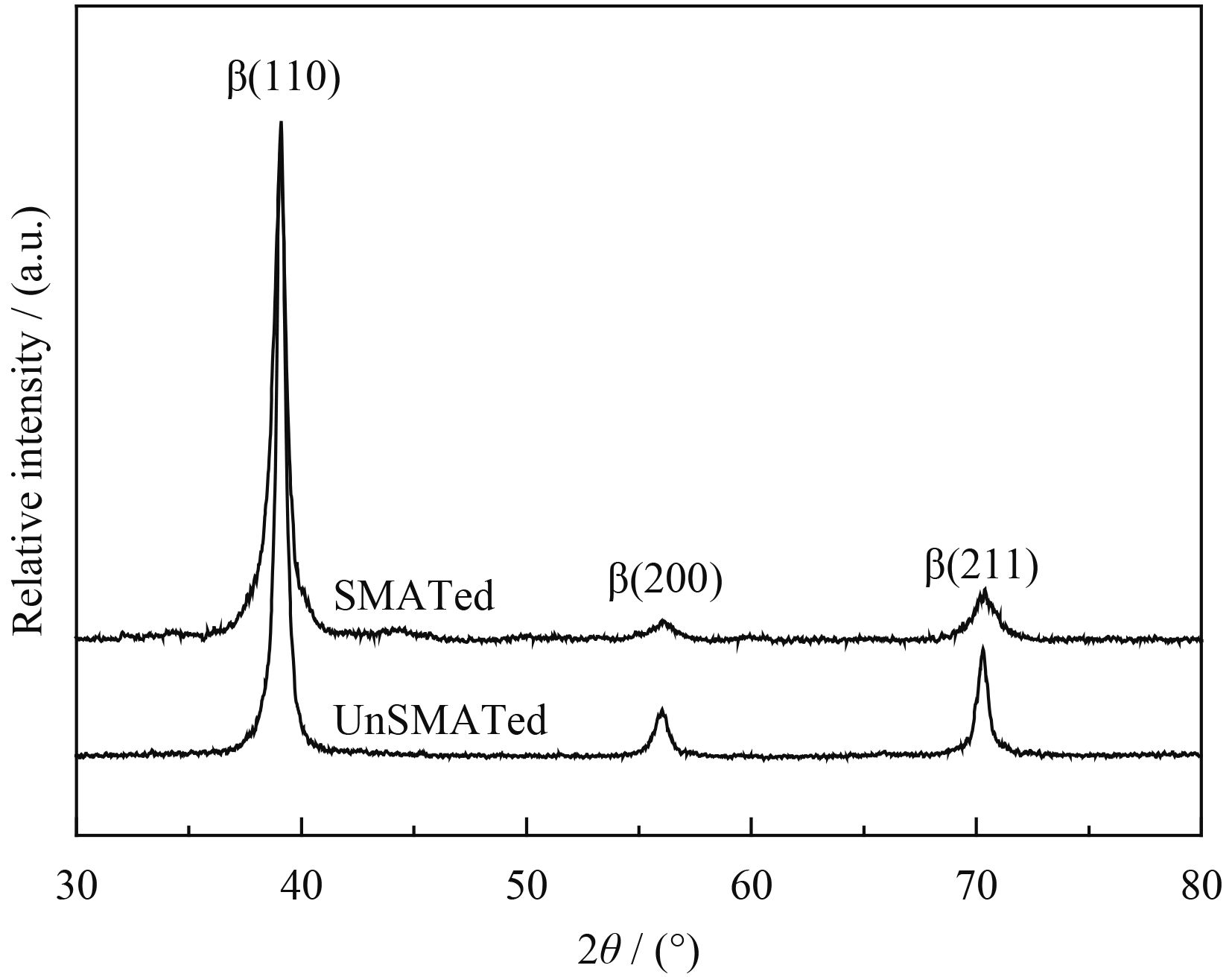
|
| 图 1 UnSMATed及SMATed钛合金样品的XRD图谱 Figure 1 XRD patterns of unSMATed and SMATed titanium alloy samples |
图2为unSMATed及SMATed两组钛合金样品表面的金相显微组织及TEM像。由图2(a)可以看出unSMATed样品由等轴状的晶粒构成,统计出的晶粒尺度为(82±9) μm;图2(b)显示,经SMAT处理后,TLM钛合金样品表层由一些任意分布的细小晶粒组成,部分晶粒表现出拉长的形貌,这是大塑性变形制备出纳米晶粒的普遍特征[13],统计出的晶粒尺度为(48±7) nm,右上方插入的选区电子衍射花样为非连续的环状,对其进行标定证实这些晶粒均为单一的β-Ti,上述结果与图1的XRD衍射结果相吻合,亦证实了TLM钛合金在经SMAT处理30 min后表层物相没有发生变化,而合金表层的β-Ti晶粒得到了明显细化。

|
| 图 2 UnSMATed钛合金样品金相显微组织及SMATed钛合金样品表层透射电镜像 Figure 2 OM image of the unSMATed titanium sample and TEM image taken from the surface layer of the SMATed titanium sample |
图3为unSMATed及SMATed两组钛合金样品表面的AFM形貌。可以看出,经机械抛光为镜面的两组TLM钛合金样品,表面均光洁平整,呈现出相近的拓扑结构。借助相连的计算机对两组样品表面的粗糙度进行统计,结果显示unSMATed样品表面的算术平均粗糙度值Ra为(18.4±2.3) nm、几何平均粗糙度值Rq为(27.9±3.1) nm、峰谷十点平均粗糙度值Rz为(98.5±5.8) nm,而SMATed样品表面的算术平均粗糙度值Ra为(19.2±1.8) nm、几何平均粗糙度Rq为(28.6±2.7) nm、峰谷十点平均粗糙度值Rz为(99.4±6.3) nm。上述结果显示,unSMATed及SMATed两组样品表面具有相近的拓扑结构及粗糙度。
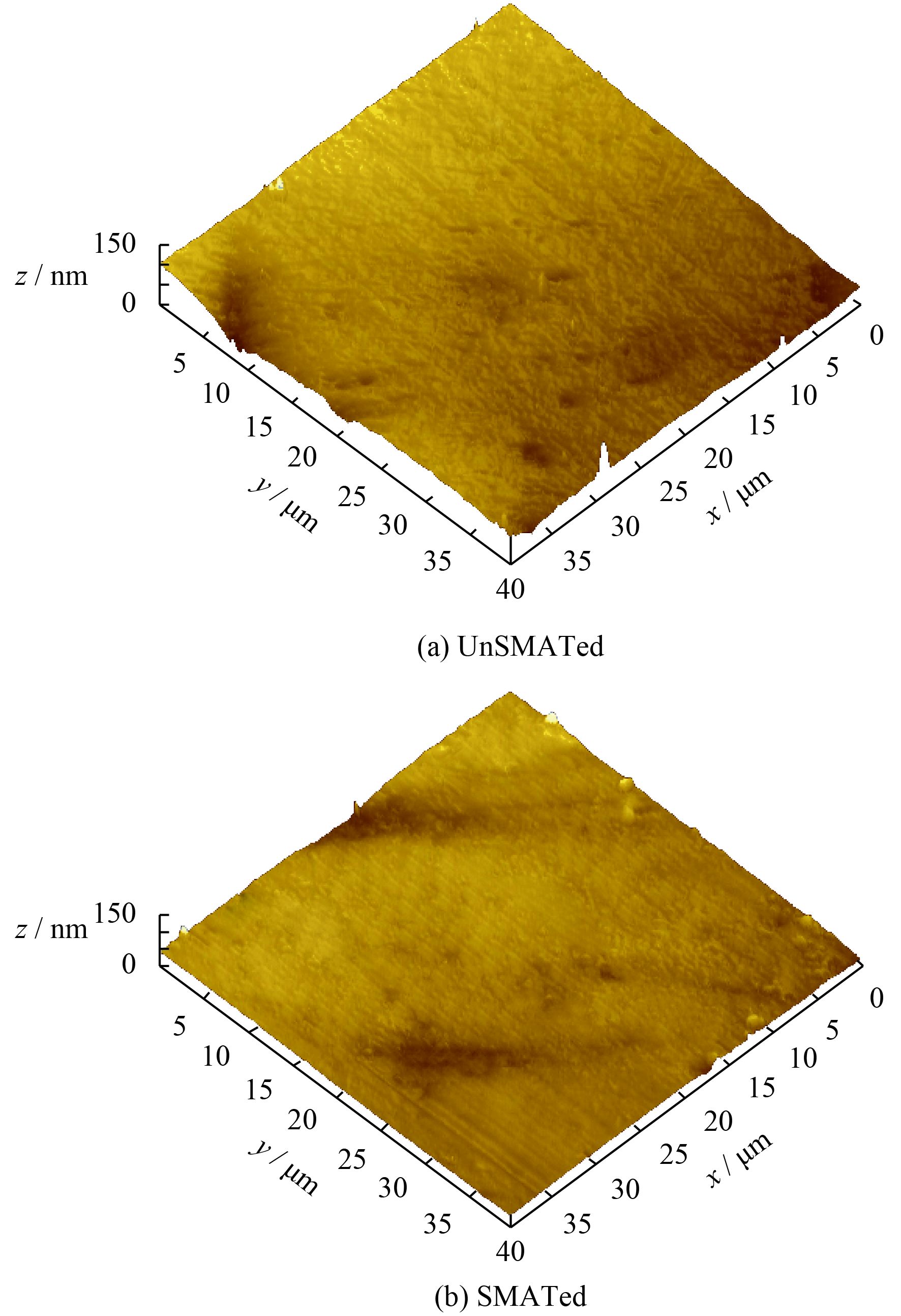
|
| 图 3 UnSMATed及SMATed钛合金样品表面的原子力显微形貌 Figure 3 AFM images of the unSMATed and SMATed surface for titaniam samples |
图4为水滴在unSMATed及SMATed两组钛合金样品表面的接触形貌,由设备自带的软件分析出unSMATed及SMATed两组样品表面的水滴接触角分别为66.3°±2.1°和51.7°±1.8°,由于越小的水滴接触角对应着材料表面越好的亲水性,上述结果表明对比unSMATed样品,SMATed样品表面具有更好的亲水性。

|
| 图 4 UnSMATed及SMATed钛合金样品表面的水滴接触形貌 Figure 4 Water-drop contact images of the unSMATed and SMATed surfaces |
图5为unSMATed及SMATed两组钛合金样品在含10%胎牛血清的细胞培养基中孵育1、5及24 h后,样品表面蛋白的吸附量。可以看出在每个孵育时间点,SMATed样品表面对蛋白的吸附量均高于unSMATed样品,随着孵育时间的延长,两组样品表面吸附的蛋白量均在增加,但在5 h前增加得较快,而5 h后则增加得较为缓慢,这是由于蛋白吸附是一个比较迅速的过程,一般在较短的时间内完成[14-15]。
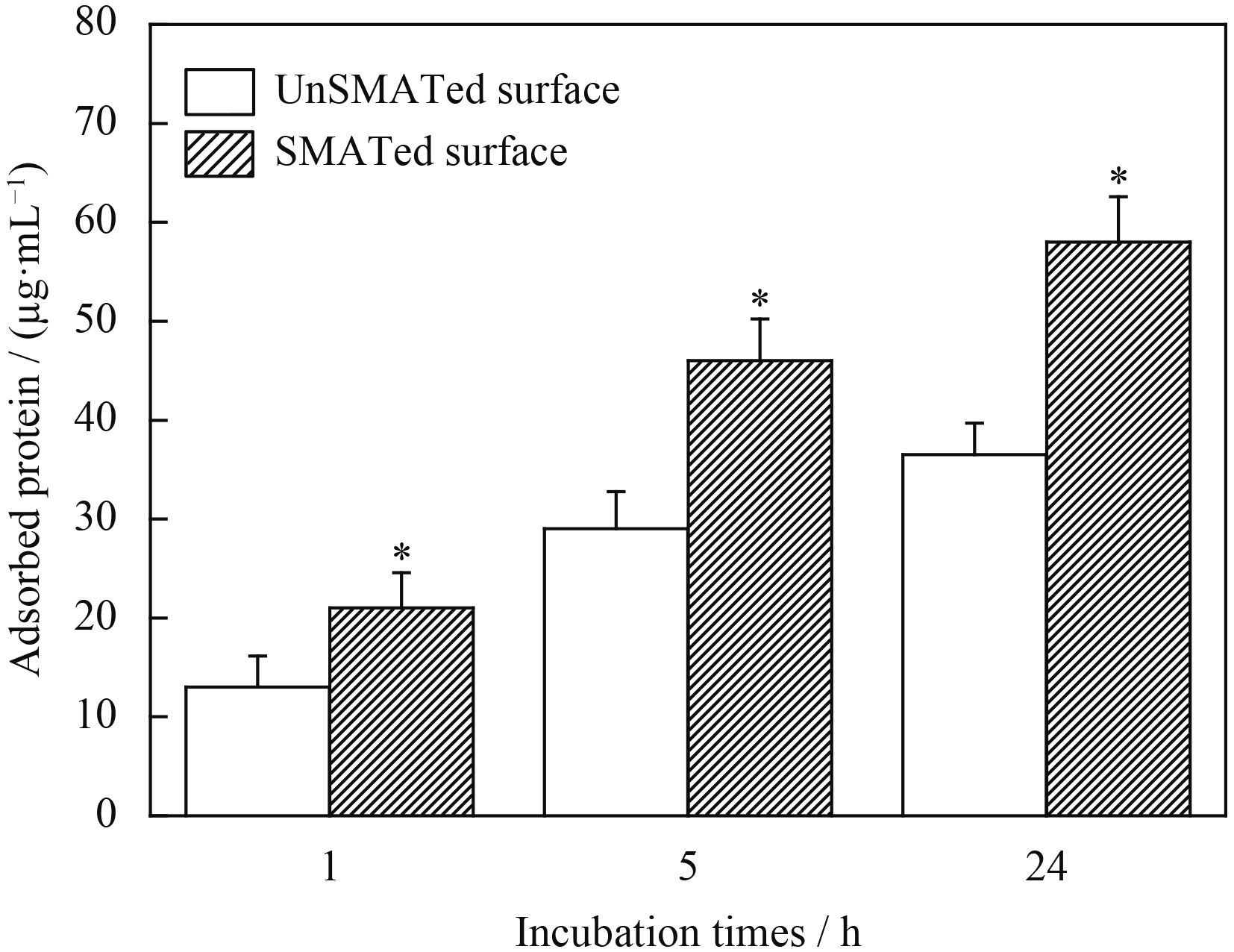
|
| 图 5 UnSMATed及SMATed钛合金样品在含10%胎牛血清的培养基中孵育1, 5和24 h后表面蛋白的吸附量 Figure 5 Protein adsorbed onto unSMATed and SMATed surface after 1, 5 and 24 h of incubation in DMEM containing 10% fetal bovine serum |
图6为hFOB1.19成骨细胞在unSMATed及SMATed两组钛合金样品表面直接接触培养3 h后的SEM形貌。由图可以看出,unSMATed钛合金样品表面的细胞体积较小,多呈立体梭状,没有充分铺展;而SMATed钛合金样品表面的细胞已充分展开,呈扁平状,牢牢黏附在TLM钛合金样品表面。

|
| 图 6 成骨细胞在unSMATed及SMATed钛合金样品表面培养3 h后的SEM形貌 Figure 6 SEM images of osteoblasts cultured for 3 h on unSMATed and SMATed surface |
图7显示成骨细胞在unSMATed及SMATed两组钛合金样品表面培养1、6、24、72及120 h后,MTT法检测到的细胞生长情况。可以看出,两组样品表面的活细胞数目均随着培养时间增加而增加,但在各个培养时间点SMATed样品表面的活细胞数均明显高于unSMATed样品,表明SMATed钛合金样品表面更有利于成骨细胞的增殖。
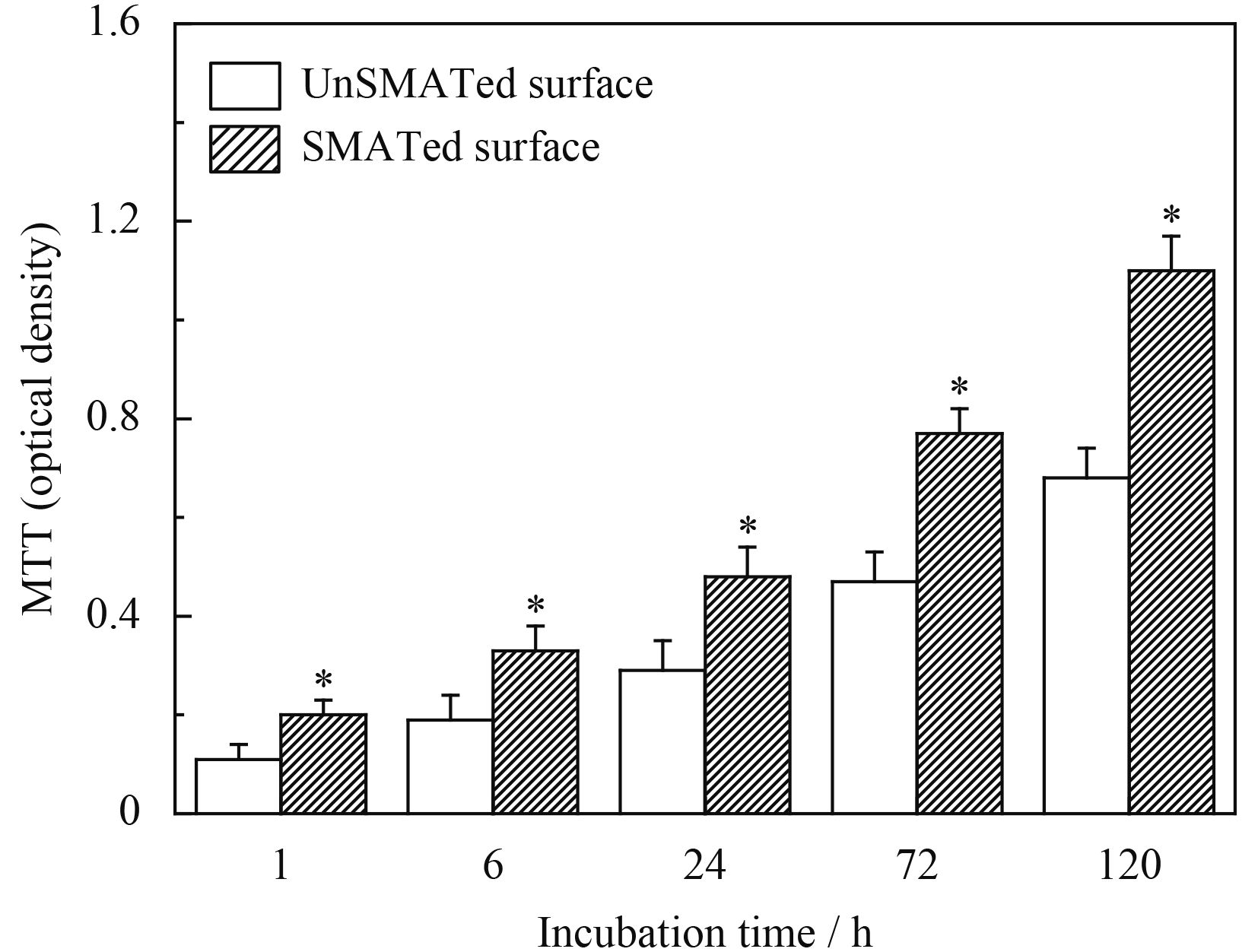
|
| 图 7 成骨细胞在unSMATed及SMATed钛合金样品表面培养不同时间后的生长活力 Figure 7 Osteoblast viability on unSMATed and SMATed surfaces after culture for different time |
图8显示成骨细胞在unSMATed及SMATed两组钛合金样品表面培养1、3及5 d后,胞内ALP活性的变化情况。由图可以看出,在两组样品表面培养不同时间后,成骨细胞的ALP活性均随孵育时间延长而增强,但在各个培养时间点SMATed样品表面成骨细胞的ALP活性均显著高于unSMATed样品表面。由于ALP活性是反映成骨细胞分化水平的重要指标[16],其活性越高,说明成骨细胞分化越明显,上述结果表明SMATed钛合金样品表面更能促进成骨细胞的分化。
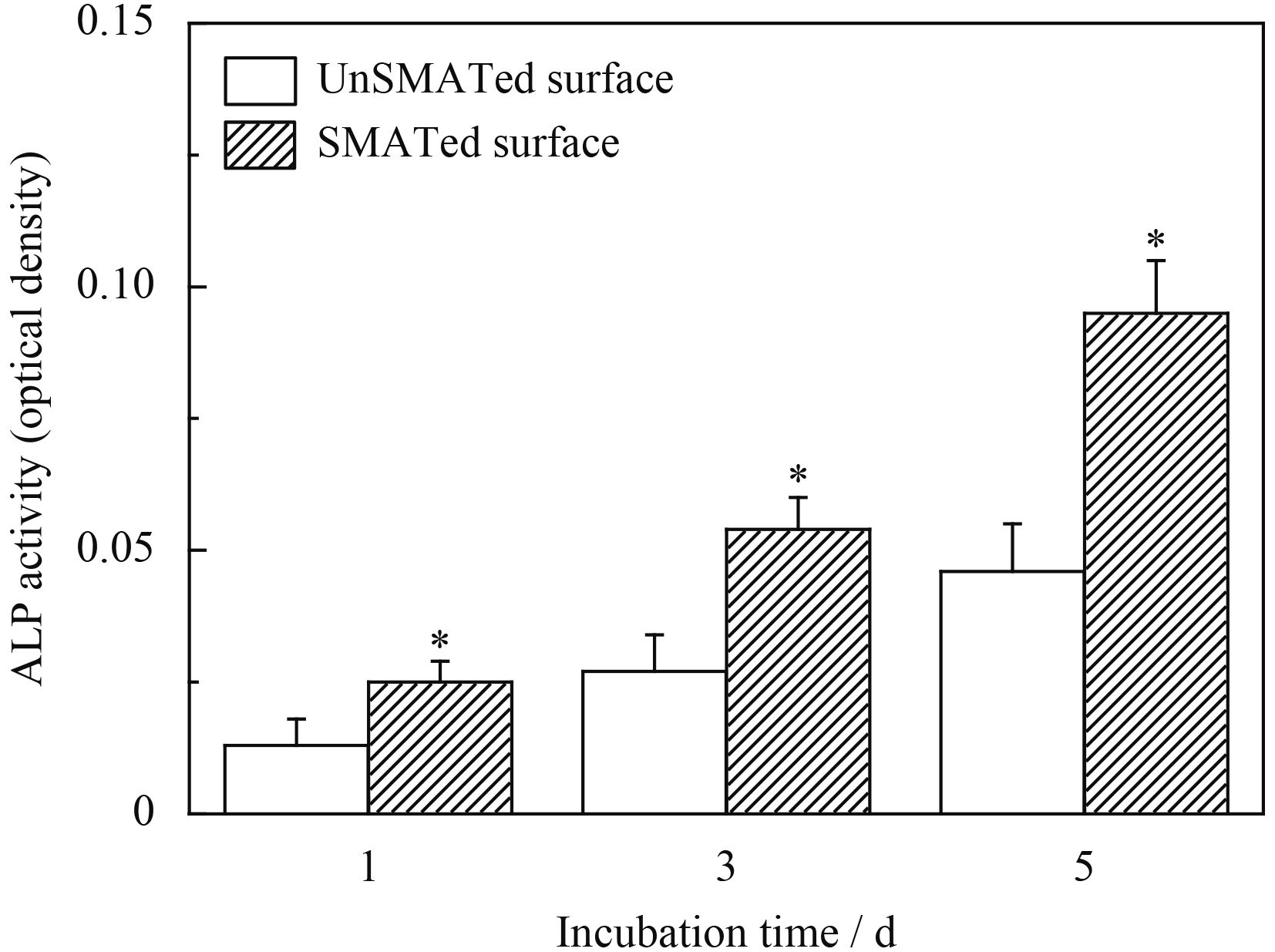
|
| 图 8 成骨细胞在unSMATed及SMATed钛合金样品表面培养不同时间后胞内的ALP表达水平 Figure 8 ALP activity in osteoblast cultured on unSMATed and SMATed surface for different time |
硬组织替代材料植入到人体后,与体液接触的是材料表面,近些年来对钛基金属生物活化改性多集中为对其表面的活化处理,方法主要包括等离子喷涂[17]、化学处理法[18-20]及电沉积法[21]等。等离子喷涂HA是目前广泛应用于人工髋关节表面改性的临床技术,但是使用该方法制备膜层时温度高,易在膜层中产生杂质及非晶相,影响其在生物体内的稳定性,此外该方法制备出的膜层与基体界面处的残余应力一般较高,导致膜基结合强度很低[22]。化学处理法是通过溶液与钛基体之间发生化学反应在钛表面生成具有生物活性凝胶层的方法,主要包括碱热处理法[18]、双氧水刻蚀法[19]、溶胶-凝胶法[20]等。化学法操作简单,且制备出的表面能提高钛的生物活性,但亦存在制备出的膜层厚度较薄,与基体之间结合较差的问题。电沉积法将生物活性涂层制备成溶液,而后沉积在钛基体上,试验过程不易控制,基体与膜层之间结合差,往往需要通过后续热处理等方法来提高膜基界面的结合强度[21]。尽管上述表面活化处理方法能不同程度提高钛基金属表面的生物活性,但制备出的膜层与基体之间易剥落的问题制约着其在临床上的广泛应用[18, 21]。文中采用SMAT的方法在TLM钛合金表面实现了纳米化,证实了该纳米结晶表层可以提高合金的细胞相容性,且制备出的纳米表层与合金基体之间不存在明显的界面,因而在植入到人体后,不会因为膜基结合不牢而发生剥层和分离,具有较大的临床应用潜力。
尽管SMAT工艺在钛基金属表面实现纳米化的同时,也会引起金属表面晶粒尺度、化学成分、粗糙度及拓扑结构的变化,这些材料的表面性质能单独或混合的对其上接种的细胞行为进行影响[23],然而本文中,UnSMATed及SMATed两组TLM钛合金样品表面具有相同的物相组成及相近的拓扑结构和粗糙度(图1及图3),因而可以将SMATed样品表面改善成骨细胞的黏附、增殖及分化情况归因于SMAT引起的表面晶粒细化(图2)。晶粒细化后的钛合金表面会产生更多的晶界,晶界是一种高能量的缺陷[13],使得合金表面处于活泼状态,表面具有更高的表面能,从而表现出更好的亲水性(图4)。
硬组织替代体在植入到人体后,其表面的细胞黏附一般可主要分为4步:蛋白吸附,胞材接触,细胞贴附及铺展[24]。在植入后的数秒内,植入体表面将从血液或周边体液中吸附各类蛋白,通过吸附的这层蛋白细胞对外界进行感知[25]。植入材料表面吸附的蛋白构型及数量对随后的胞材作用有着重要的影响。据报道,亲水性更好的材料表面能促使表面吸附的蛋白处于更活泼的构型,从而有利于细胞在材料表面的黏附[26],而蛋白量吸附更多的材料表面也更加有利于细胞的黏附[27]。上述制备出的SMATed样品和UnSMATed样品相比,表面具有更好的亲水性因而能使表面吸附的蛋白处于更具有生物活性的构型,且其在血清中孵育时表面能吸附更高的蛋白量(图5),因而成骨细胞在其表面表现出更好的黏附作用。细胞铺展发生在黏附末期,在这一过程中,细胞重组肌动蛋白骨架,形成应力纤维,使细胞平和展开,文中,SMATed样品表面具有较高的表面能,因而能吸附更多含RGD序列的锚定蛋白,如纤连蛋白(Fn)及玻连蛋白(Vn)等,它们能与细胞的整合素受体结合,诱发更多应力纤维的形成[26, 28],从而促进细胞的铺展(图6)。细胞黏附是人体与生物材料相互作用的第一阶段[25],影响着随后细胞的增殖及分化过程,因此晶粒细化后的TLM钛合金样品表面不仅有利于其上成骨细胞的黏附,亦促进了其后成骨细胞的增殖及分化。由于胞材作用更好的植入体表面能诱发更强的骨整合,文中的研究将有助于设计和开发出生物学效应更加优异的硬组织置换体。
4 结 论对TLM钛合金表面进行SMAT处理,而后将处理前后的钛合金样品机械抛光成镜面,制备出相组成相同,表层粗糙度、拓扑结构近似,而表层晶粒尺度不同的两组样品。晶粒细化后的TLM钛合金样品表面表现出更强的蛋白吸附能力,从而促进了其上成骨细胞的黏附、增殖及分化,这与晶粒细化后的合金表面具有更好的亲水性有关,该研究结果有望为开发出更符合临床应用的钛金属硬组织替换体提供新的思路。
| [1] | GEETHA M, SINGH A K, ASOKAMANI R, et al. Ti based biomaterials, the ultimate choice for orthopaedic implants-A review[J]. Progress in Materials Science, 2009, 54(3): 397-425. |
| 点击浏览原文 | |
| [2] | VERONESI F, GIAVARESI G, FINI M, et al. Osseointegration is improved by coating titanium implants with a nanostructured thin film with titanium carbide and titanium oxides clustered around graphitic carbon[J]. Materials Science and Engineering C, 2017, 70(1): 264-271. |
| [3] | BACAKOVA L, FILOVA E, LISKOVA J, et al. Nanostructured materials as substrates for the adhesion, growth, and osteogenic differentiation of bone cells[J]. Nanobiomaterials in Hard Tissue Engineeing, 2016, 4: 103-153. |
| [4] | WEBSTER T J, EJIOFOR J U. Increased osteoblast adhesion on nanophase metals: Ti, Ti6Al4V, and CoCrMo[J]. Biomaterials, 2004, 25(19): 4731-4739. |
| 点击浏览原文 | |
| [5] | ZHAO C L, CAO P, JI W P, et al. Hierarchical titanium surface textures affect osteoblastic functions[J]. Journal of Biomedical Materials Research Part A, 2011, 99A(4): 666-675. |
| 点击浏览原文 | |
| [6] | ZHAO C L, JI W P, HAN P, et al. In vitro and in vivo mineralization and osseointegration of nanostructured Ti6Al4V[J]. Journal of Nanoparticle Research, 2011, 13(2): 645-654. |
| 点击浏览原文 | |
| [7] | LAI M, CAI K Y, HU Y, et al. Regulation of the behaviors of mesenchymal stem cells by surface nanostructured titanium[J]. Colloids and Surface B: Biointerfaces, 2012, 97(5): 211-220. |
| [8] | DENG Z N, YIN B D, LI W H, et al. Surface characteristics of and in vitro behavior of osteoblast-like cells on titanium with nanotopography prepared by high-energy shot peening [J]. International Journal of Nanomedicine, 2014, 9(1): 5565-5573. |
| [9] | GUO Y Y, HU B B, TANG C, et al. Increased osteoblast function in vitro and in vivo through surface nanostructuring by ultrasonic shot peening[J]. International Journal of Nanomedicine, 2015, 10: 4593-4603. |
| [10] | YU Z T, ZHOU L. Influence of martensitic transformation on mechanical compatibility of biomedical β type titanium alloy TLM[J]. Materials Science and Engineering A, 2006, 438-440(12): 391-394. |
| [11] | LU K, LU J. Nanostructured surface layer on metallic materials induced by surface mechanical attrition treatment[J]. Materials Science and Engineering A, 2004, 375-377(1): 38-45. |
| [12] | HUANG R, ZHUANG H Y, HAN Y. Second-phase-dependent grain refinement in Ti-25Nb-3Mo-3Zr-2Sn alloy and its enhanced osteoblast response[J]. Materials Science and Engineering C, 2014, 35(3): 144-152. |
| [13] | HUANG R, HAN Y. Structure evolution and thermal stability of SMAT-derived nanograined layer on Ti-25Nb-3Mo-3Zr-2Sn alloy at elevated temperatures[J]. Journal of Alloys and Compounds, 2013, 554: 1-11. |
| 点击浏览原文 | |
| [14] | BHAKTA S A, EVANS E, BENAVIDEZ T E, et al. Protein adsorption onto nanomaterials for the development of biosensors and analytical devices: A review[J]. Analytica Chimica Acta, 2015, 872: 7-25. |
| 点击浏览原文 | |
| [15] | ANSELME K, DAVIDSON P, POPA A M, et al. The interaction of cells and bacteria with surfaces structured at the nanometre scale[J]. Acta Biomaterialia, 2010, 6(10): 3824-3846. |
| 点击浏览原文 | |
| [16] |
徐立虎, 韵向东, 陈元哲, 等. 携载壳聚糖/rhBMP-2缓释微球的NiTi合金的制备及体外检测[J]. 中国表面工程, 2013, 26(4): 94-98.0
XU L H, YUN X D, CHEN Y Z, et al. Preparation and properties in vitro of rhBMP-2 loaded chitosan microsphere coated by nitinol[J]. China Surface Engineering, 2013, 26(4): 94-98 (in Chinese). |
| 点击浏览原文 | |
| [17] | ZHAO X B, LIU X Y, DING C X, et al. Effects of plasma treatment on bioactivity of TiO2 coatings[J]. Surface & Coatings Technology, 2007, 201(15): 6878-6881. |
| [18] | DONG W J, ZHANG T R, EPSTEIN J, et al. Multifunctional nanowire bioscaffolds on titanium[J]. Chemistry of Materials, 2007, 19(18): 4454-4459. |
| 点击浏览原文 | |
| [19] | HSU H C, WU S C, HSU S K, et al. Bioactivity of hybrid micro/nano-textured Ti-5Si surface by acid etching and heat treatment[J]. Materials & Design, 2016, 104: 205-210. |
| [20] | PATSI M E, HAUTANIEMI J A, RAHIALA H M, et al. Bonding strengths of titania sol-gel derived coatings on titanium[J]. Journal of Sol-Gel Science and Technology, 1998, 11(1): 55-66. |
| 点击浏览原文 | |
| [21] | CHEN H J, WANG C L, YANG X, et al. Construction of surface HA/TiO2 coating on porous titanium scaffolds and its preliminary biological evaluation[J]. Materials Science and Engineering C, 2017, 70(2): 1047-1056. |
| [22] | YANG Y C, CHANG E. Influence of residual stress on bonding strength and fracture of plasma-sprayed hydroxyapatite coatings on Ti-6Al-4V substrate[J]. Biomaterials, 2001, 22(13): 1827-1836. |
| 点击浏览原文 | |
| [23] |
白杨, 刘其斌, 徐鹏, 等. 稀土含量对Ca-P陶瓷涂层组织及细胞相容性的影响[J]. 中国表面工程, 2016, 29(5): 66-71.0
BAI Y, LIU Q B, XU P, et al. Effects of rare earth content on microstructure and cell compatibility of Ca-P ceramic coating fabricated by laser cladding[J]. China Surface Engineering, 2016, 29(5): 66-71 (in Chinese). |
| 点击浏览原文 | |
| [24] | LIU X M, LIM J Y, DONAHUE H J, et al. Influence of substratum surface chemistry/energy and topography on the human fetal osteoblastic cell line hFOB 1.19: Phenotypic and genotypic responses observed in vitro[J]. Biomaterials, 2007, 28(31): 4535-4550. |
| 点击浏览原文 | |
| [25] | ANSELME K. Osteoblast adhesion on biomaterials[J]. Biomaterials, 2000, 21(7): 667-681. |
| 点击浏览原文 | |
| [26] | WEBSTER T J, SCHADLER L S, SIEGEL R W, et al. Mechanisms of enhanced osteoblast adhesion on nanophase alumina involve vitronectin[J]. Tissue Engineering, 2004, 7(3): 291-301. |
| [27] | ARIMA Y, IWATA H. Preferential adsorption of cell adhesive proteins from complex media on self-assembled monolayers and its effect on subsequent cell adhesion[J]. Acta Biomaterialia, 2015, 26: 72-81. |
| 点击浏览原文 | |
| [28] | HUANG R, LU S M, HAN Y. Role of grain size in the regulation of osteoblast response to Ti-25Nb-3Mo-3Zr-2Sn alloy[J]. Colloids and Surfaces B: Biointerfaces, 2013, 111(6): 232-241. |



